टायटॅनियम
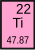
(Ti) (अणुक्रमांक २२) रासायनिक पदार्थ.
| सामान्य गुणधर्म | ||||||||
|---|---|---|---|---|---|---|---|---|
| साधारण अणुभार (Ar, standard) | ग्रॅ/मोल | |||||||
| टायटॅनियम - आवर्तसारणीमधे | ||||||||
| ||||||||
| अणुक्रमांक (Z) | २२ | |||||||
| गण | अज्ञात गण | |||||||
| भौतिक गुणधर्म | ||||||||
| घनता (at STP) | ग्रॅ/लि | |||||||
| आण्विक गुणधर्म | ||||||||
| इतर माहिती | ||||||||

इतिहास
१७९१ साली इंग्लिश रसायनशास्त्रज्ञ व खनिजशास्त्रज्ञ विल्यम ग्रेगॉर यांना एक नवा धातू मेनकॅनाइट खनिजात सापडला त्याव्रून त्यांनी त्याचे नाव मेनाकिन असे ठेवले. पुढे १७९५ साली जर्मन रसायनशास्त्रज्ञ मार्टिन हेन्रिक क्लॅपरॉथ यांना रुटाइलच्या खनिजात हा धातू सापडला. क्लॅपरॉथ यांना आधीच्या शोधाबद्दल काहीच माहीत नव्हते, त्यांनी त्याचा शास्त्रीय अभ्यास करून त्यास टायटॅनियम असे नाव दिले. क्लॅपरॉथ यांनाच टायटॅनियमच्या शोधाचे श्रेय दिले जाते.

त्यानंतर अनेक शास्त्रज्ञांनी शुद्ध स्वरूपात टायटॅनियम मिळविण्याचे प्रयत्न केले. १८२३ साली इंग्लिश रसायनशास्त्रज्ञ वोलॅस्टन यांना टायटॅनियमचे काही स्फटिके मिळविण्यात यश आले. तर १८२५ साली स्वीडिश रसायनशास्त्रज्ञ व खनिजशास्त्रज्ञ बर्झेलियस यांनी पोटॅशियम फ्ल्युरोटायटॅनेट याचे सोडियमच्या सहाय्याने क्षपण करून प्रथमतः धातूरूप टायटॅनियम मिळविले. १८८५ साली रशियन रसायनशास्त्रज्ञ किरिलोव यांना धातूरूपातील शुद्ध टायटॅनियम मिळविता आले. त्यापुढील प्रयत्नात १८९५ साली फ्रेंच रसायनशास्त्रज्ञ हेन्री मॉइसन यांना ९८ % शुद्ध टायटॅनियम मिळविता आले. पण यापैकी एकही पदार्थ शुद्ध टायटॅनियम नव्हता. अशुद्धतेचे काही दशांश भाग जरी यात राहिले तर टायटॅनियम सहज तुटणारा, ठिसूळ आणि यांत्रिक कामास निरूपयोगी ठरतो. १९२५ साली डच रसायनशास्त्रज्ञ फॉन आर्केल आणि द बोअर यांनी टंग्स्टनच्या तप्त तारेवर टायटॅनियम टेट्राक्लोराईडचे विघटन करून अतिशुद्ध स्वरूपाचे टायटॅनियम मिळविले.
ताकदीबाबत टायटॅनियमला औद्योगिक धातूंमध्ये प्रतिस्पर्धी नाही असे म्हणले तरी ते चूक ठरणार नाही. टायटॅनियम हा एक अतिकठीण धातू आहे. ऍल्युमिनियमपेक्षा याची कठीणता १२ पट आणि लोखंड व तांब्यापेक्षा ४ पट अधिक आहे. त्यामुळे विमानामध्ये टायटॅनियमचा उपयोग मोठ्या प्रमाणात करण्यात येतो. विशेषतः विमानाची इंजिने टायटॅनियम धातू वापरून बनविली जातात त्यामुळे त्यांचे वजन तर कमी होतेच पण इंधनाची मोठी बचतही होते. उच्च तपमानाशी संबंधीत सर्वच क्षेत्रात टायटॅनियमचा मोठ्या प्रमाणात उपयोग होतो. चुंबकीय गुणधर्माचा अभाव हे आणखी एक वैशिष्ट्य टायटॅनियमच्या अंगी आहे. विद्युतवाहकतेचा निकष तपासला आणि चांदीची विद्युतवाहकता जर १०० गृहीत धरली तर तांब्याची ९४, ऍल्युमिनियमची ५५, पारा आणि लोखंडाची २ भरेल तर टायटॅनियमची विद्युतवाहकता ०.३ ठरेल.
साठे
पृथ्वीवर टायटॅनियमचे जे प्रमाण आहे ते तांबे, जस्त, शिसे, सोने, चांदी, प्लॅटिनम, टंग्स्टन, पारा, क्रोमियम, मॉलिब्डेनम, बिस्मथ, ॲंटिमनी, निकेल आणि कथील यासह इतर काही धातूंच्या आणि खनिजांच्या एकत्रित प्रमाणापेक्षाही अधिक आहे. तर ज्या खनिजांमध्ये डायऑक्साइड्च्या स्वरूपात किंवा टायटॅनिक आम्लाच्या स्वरूपात टायटॅनियम आढळते असे ७० च्या वर प्रकार उपलब्ध आहेत. टायटॅनियम खनिज आढळणारी जगात एकूण १५० च्या वर ठिकाणे आहेत.
उपयोग
घड्याळे, मोबाईल फोन, इलेक्ट्रॉनिकच्या असंख्य वस्तु, मोटारी, विमाने, रेल्वे, मेट्रो, हाड मोडल्यावर शस्त्रक्रिया करून हाड जोडण्यासाठी अशा सर्व ठिकाणी टायटॅनियम धातू वापरला जातो.
नावाची व्युत्पत्ती
ग्रीक पुराणकथेनुसार पृथ्वी पुत्र टायटन याच्या नावावरून या धातूस टायटॅनियम नाव देण्यात आले. याला आधुनिक जगाचा धातू असेही म्हणले जाते.
| H | He | |||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | |||||||||
| ||||||||||||||||||||||||||||||||||||||||